研究テーマ
研究を志望する方へ
免疫学教室では、「ヒトがんの免疫病態の解明とその制御」を主要テーマとして研究を進めています。
ヒト悪性黒色腫、非小細胞性肺がん、胃がんなどに対する免疫チェックポイント阻害薬、抗PD-1抗体治療において、明らかに治療効果が認められた奏効例と効かなかった非奏効例の臨床検体(末梢血や腫瘍組織)を用い、さまざまな最新技術を駆使して比較解析を実施し、「抗腫瘍免疫応答」と「免疫抑制・抵抗性」の機序の解明に挑戦しています。また、臨床検体解析で得られたデータに基づいて、各種マウス腫瘍モデル(遺伝子改変マウスや免疫系ヒト化マウス等)を用いて、抗腫瘍免疫を増強する薬(低分子化合物や抗体)や免疫抵抗性を解除する薬を探索しています。
免疫制御法は、大きく2つに分類されます。1)患者さんご自身の抗腫瘍免疫を免疫チェックポイント阻害薬やがんワクチン等で増強する治療法、2) 免疫を誘導するがん抗原が存在しないなどの理由で患者さんの免疫が期待できない場合、モノクローナル抗体、改良型抗がん剤結合抗体、2重特異性抗体、CAR-T/TCR-Tなど遺伝子改変抗腫瘍T細胞などの人工的ながん免疫薬を作製して使う治療法。前者では、がんの免疫病態に個人差が大きく、治療法や治療効果に影響します。同じ組織のがんでも、免疫抵抗性機序が異なる免疫サブタイプに分類でき、免疫サブタイプに対応した治療法が必要です。私たちは、特に抗PD-1/PD-L1抗体を基軸として、免疫サブタイプに対応して適切な免疫抵抗性解除薬を併用する、個別化・複合がん免疫療法(Precision Medicine)を提案しています。後者では、CAR-T/TCR-Tなど遺伝子改変抗腫瘍T細胞の作製を進めています。以下に各研究テーマを説明します。
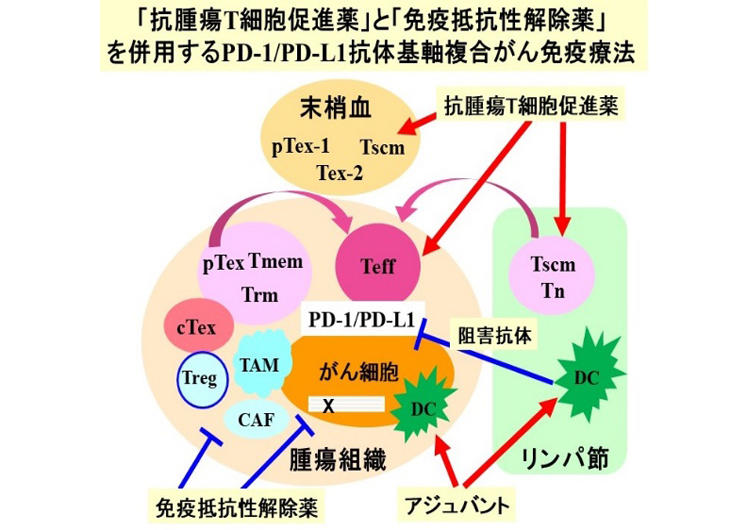
1) 腫瘍抗原特異的T細胞応答の解明と制御法の開発
私たちは、T細胞が認識するヒト腫瘍抗原の同定(DNA突然変異由来ネオ抗原、がん精巣抗原、組織特異抗原、HPV等ウイルス抗原)と腫瘍抗原特異的T細胞応答について研究を進めてきました。最近は、免疫チェックポイント阻害薬の奏効例と非奏効例の末梢血免疫細胞のscRNA-seqを用いたシングルセルレベルでの網羅的遺伝子発現解析により、抗腫瘍効果と正に相関するCD8+T細胞サブセットとCD4+T細胞サブセットを同定しており、T細胞サブセットの解析と制御法の開発を進めています。制御法の一つとして、各種代謝の調節が重要であることを見出しており、注目して研究をしています。生体内でのがん細胞排除に重要なT細胞サブセットの増殖を促進させる薬は、その直接投与だけでなく、CAR-Tなど体外培養抗腫瘍T細胞の調製にも利用できます。またT細胞サブセットの測定は、免疫療法における治療効果予測などの診断法の開発にもつながります。
2) 免疫サブタイプに関連する多様な免疫抵抗性の機序解明と制御法の開発
私たちは、今までに、各種ヒトがんで多様な免疫サブタイプを明らかにし、対応する免疫抵抗性機序の解明を進めてきました。しかし、まだ十分に解明されていないことから、網羅的遺伝子発現解析や体系的な免疫組織染色法などを基盤とした、マルチオミックス解析などの最新技術を駆使して、さらなる解析を進めています。免疫サブタイプのうち、DNA修復系 (DNAミスマッチ修復(MSI)やPOLE異常等) も関係する突然変異が多いがんは、T細胞反応が良く、免疫チェックポイント阻害薬が奏効することが分かりましたが、十分に効かない症例も存在し、その機序の解明を進めています。他にも、各種代謝異常をもつサブタイプ、間葉系がん微小環境をもつサブタイプなど、まだ病態が解明されていないサブタイプが存在し、その解析を進めています。がん免疫病態の個人差は、がん細胞だけでなく、患者さんの免疫体質や環境因子・生活習慣にも左右されることから、腸内細菌叢や併用薬などの研究も進めています。
各免疫サブタイプに関与する免疫抵抗性を解除する薬(キナーゼ阻害剤、転写因子阻害剤、代謝調節剤、免疫抑制細胞・分子阻害剤、抗原提示細胞増強アジュバント等)を各種スクリーニング法で探索・同定し、マウス腫瘍モデルで治療効果と作用機序を評価することにより、各免疫サブタイプに対応した免疫抵抗性解除薬と抗PD-1/PD-L1抗体を併用する複合がん免疫療法の開発を進めています。


3)遺伝子改変抗腫瘍T細胞の作製
人工的な抗腫瘍免疫として、キメラ抗原受容体遺伝子導入T細胞(CAR-T)などの遺伝子改変T細胞を作製し、実験動物中央研究所と共同で開発した、免疫不全NOGマウスを基盤とした各種免疫系ヒト化マウスなども用いて、その治療効果の評価と改良を進めています。また、慶應義塾大学病院と連携して、子宮頚がんや悪性黒色腫に対する体外培養腫瘍浸潤T細胞を用いた養子免疫療法(TIL療法)の臨床試験を進めています。
*免疫学教室では、ここに紹介した研究テーマ以外にも、他大学や医療機関、また企業との連携研究も進めています。
今までの私たちのがん免疫研究の歴史
免疫学教室代表者(河上裕)は 長年、がん免疫研究、特に抗腫瘍T細胞応答の解明とがん免疫療法の開発に取り組んできました。1990年代に臨床試験で治療効果を示したヒト腫瘍浸潤T細胞の抗原認識機構の解明(T細胞認識ヒトがん抗原の同定と形成機序)に成功し(PNAS1994, JExpMed1988等)、がん抗原特異的免疫療法の開発とともに、抗腫瘍免疫応答測定法の開発により、ヒトがん免疫応答の科学的な解析を可能にしました(NatureMed1998等)。同時に免疫抵抗性機序として、HLA消失の分子機構を解明し(JNCI1996)、DNAミスマッチ修復酵素異常をもつ大腸がんにおけるフレームシフト変異ペプチドに対する免疫応答の証明(CanRes2005)など、各種ヒトがん種でがん抗原を同定して抗腫瘍免疫応答を解析しました。2000年以降は、がんの免疫逃避機構の解明に取り組み、がん遺伝子活性化(JExpMed2006, JImmunol2012等)、代謝異常(CanSci2021, J ImmunotherCancer2022等)、間葉系がん微小環境(CancerCell2009, J Immunother2013等)など多様な免疫抵抗性機序を明らかにしてきました。また、免疫制御法として、低分子化合物や抗体に加えて、がん溶解性ウィルスや培養樹状細胞や遺伝子改変T細胞などの開発を進めてきました(CanGeneTher2002, ClinCanRes2006, JImmunol2011, CanSci2015, MelRes2017, eLife2020等)。
2014年から基盤研究S 「がん免疫病態の個体差の解明と制御による個別化がん治療開発」、および2019年からAMED次世代がん研究「免疫チェックポイント阻害剤反応性を考慮したがん免疫微小環境とそれを反映する血液因子の解析による免疫制御分子の同定と制御法の開発」などの支援を得て、臨床検体を用いたシステム生物学的・免疫学的解析と臨床病理学的因子との相関解析によるヒトがん免疫病態の解析、およびマウス腫瘍モデルやヒトがん細胞移植ヒト免疫系化マウスを用いたin vivo実験等を駆使して、がん免疫制御のための治療標的の探索と制御法の開発を進めてきました。その結果、悪性黒色腫、大腸がん、肺がんなど、各種がんにおける免疫サブタイプを同定し、並行して進めた免疫制御化合物の探索研究と合わせて、各免疫サブタイプに対応した免疫制御法の提案をしてきました(BrJCan2014, JInvDerm2015, CanSci2015, AnnOncol2016, EurJCan2017, CanSci2017, ClinCancerRes2021)。一部のサブタイプでは、がん細胞の遺伝子異常から免疫動態、そして治療反応性まで、分子・細胞レベルでの説明が可能になりましたが、まだ病態の解明に至っていないサブタイプが存在します。
この研究過程で、大腸がんでは国際共同研究(河上は日本代表)により、腫瘍浸潤CD8+T細胞の手術後予後への意義を3000以上の症例で検証し、新規診断法としてImmunoscoreを提案しました(Lancet 2018, JCO2020, Cancers2022)。また、各種免疫系ヒト化マウスを作製し、ヒトがん免疫応答をin vivoで検討する基盤を作りました (CellMolImm2017等)。環境因子として腸内細菌叢も抗腫瘍免疫応答に関与し、免疫制御薬になり得ることを報告しました (Nature 2019)。AMED研究では、PD-1抗体治療症例のシングルセルT細胞解析により、生体内でのがん排除に重要と考えられる、奏効症例で増加するCD8+T細胞やCD4+T細胞サブセットを同定し、その解析と制御の研究が進んでいます。
